每块成功的充电电池背后,都有一群科学家
近日,斯坦福大学的戴宏杰研究组在《自然》发表论文,宣布研发出了充电极快、寿命超长的铝离子电池,引起了广泛关注。比起耳熟能详的“锂电池”,人们对铝离子电池的感觉要陌生得多。为什么要研发这样的新电池?这还得从充电电池的发展说起。
初中时,我有一部黄色的随身听。我给它准备了 3 对充电电池轮番上阵,这样,当周杰伦的声音突然变得缓慢时,我知道总有电池可以更换。后来,我有了 MP3 和手机,就渐渐不再听随身听了,需要经常充电的,也从圆柱形的 5 号电池换成了扁扁的锂电池。在我看来,世上无法逃避的事情,除了死亡和交税,还有给电池充电。
不是每一节电池都叫可充电电池
电池是生活中再常见不过的物品了。它进入人类世界已有 200 年的历史。早在 1800 年,意大利科学家亚历山德罗·伏特(Alessandro Volta)就发明了“伏打电堆”。伏打电堆由很多个单元堆叠而成,每个单元都有一块铜板和一块锌板,中间由一块浸有盐水的布隔开。时至今日,生活中常见的碱性电池、铅酸电池、锂电池等电池,都与古老的伏打电堆共享着同样的工作原理:通过氧化还原反应将自己储存的化学能转化为电能。

描绘伏特(左)向拿破仑(右)展示伏打电堆的画作。图片来源:66south.com
这一看似神奇的过程其实并不复杂。一块电池主要由正极、负极和电解液三部分组成。当电池与外电路联通时,负极一端就开始发生氧化反应,释放出电子;正极一端则发生还原反应,正好需要补充电子。由于电解液将两极隔开,只允许离子流动,不允许电子流动,于是电子通过外电路从负极流向正极,形成电流做功,化学能也藉此转化成了电能。
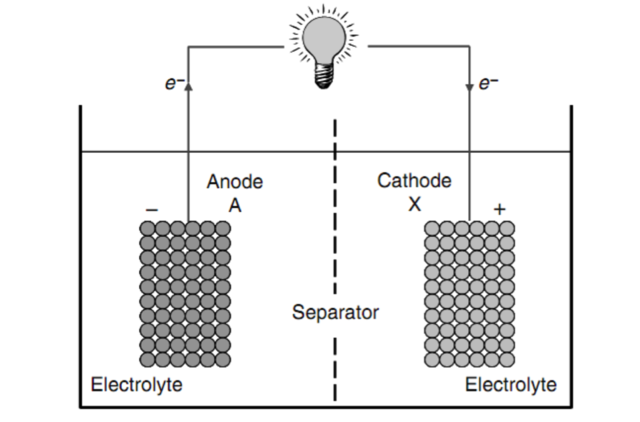
原电池示意图。阳极(Anode,即负极)与阴极(Cathode,即正极)浸泡在电解液中,图片来源:Arumugam Manthiram, Smart Battery MaterialsIn, CRC Press, 2009, pp. 8.
但如果用一次性电池为随身听供电,那么一张专辑刚刷几遍,电池就该扔了。一次性电池的电化学反应是不可逆的,也就是说,化学能转化为电能的旅程只能一条路走到黑,电量用尽,电池也没用了。好在,可充电电池采用的是可逆的电化学反应,只要施加外电压,改变电子流动的方向(从正极流向负极),电池两极就会发生与放电时方向相反的化学反应,仿佛“返老还童”,最终重新充满电力。
世界上最早的可充电电池是铅酸电池,由法国物理学家加斯顿·普兰特(Gaston Planté)于 1859 年发明。这项发明影响之深远令人不服不行——时至今日,人们在启动汽车引擎时使用的蓄电池依然是铅酸电池。铅酸电池的负极与正极分别采用海绵铅及二氧化铅,电解液使用稀硫酸。它可以提供很大的电流,价钱也不贵,但就是体积太大了些。

普兰特和他发明的铅酸电池。图片来源:bb-batteryasia.com
铅酸电池做不到面面俱到?没关系,后面还有一堆科学家跃跃欲试呢。此后,研究者们又不断探索,发明出采用其他化学反应的充电电池,如镍镉电池、镍氢电池和锂电池。它们能量密度更大,体积更小,可以用于为各类小型电子设备提供电能。
青出于蓝的锂离子电池
之前说到,电池工作时,电子通过外电路从负极流向正极。与此同时,相同电荷量的正离子则在电池内部从负极向正极流动。早期的电池都使用诸如稀硫酸这样的以水为溶剂的电解液。在这种情况下,电池内肩负维持电荷平衡任务的是氢离子。然而,使用水系电解液的电池,最多能达到的工作电压也不过 2 伏左右。如果我们想要获得更高的电压,输出更大功率,就要使用不含水的电解液,找到替代氢离子的正离子。
查看元素周期表,最佳的候选者落在了锂离子身上:作为 3 号元素,锂的原子量只有 6.9;它既轻又小,比其他大的离子更容易在电解液中移动,可谓不二之选。确定了锂离子,接下来的任务,就是找到可以与之发生可逆反应的电极材料了。到 20 世纪 70 年代,美国化学家斯坦利·惠廷厄姆(M. Stanley Whittingham)在埃克森(Exxon)工作时率先发明了锂离子电池。经过多年优化,商业化的可充电锂离子电池在 20 世纪 90 年代初在日本推出。

斯坦利·惠廷厄姆目前仍是下一代锂电池设计的重要研发者。图片来源:binghamton.edu
锂离子电池的负极使用石墨,正极使用钴酸锂,电解液则使用含有锂盐(如六氟磷酸锂)的有机溶剂。放电时,嵌入在石墨负极中的锂被氧化进入电解液,跑到正极嵌入到氧化钴的晶格间隙中形成钴酸锂;充电时,锂则从钴酸锂中脱嵌,溜回石墨中,如此循环往复。这样的电池,工作电压可达到 4 伏以上,能量密度大大提高。
但所谓金无足赤,尽管锂离子电池大获成功,也免不了还有缺点——比如价格较高,容量流失,以及最严重的安全性不高的问题。锂离子电池电解液使用的有机溶剂十分易燃,虽然我们可以通过加入添加剂和改进电池设计来提高电池的稳定性,却终究不是长久之计。
厚望加身的铝离子电池
原理上,我们只要用另一种X离子来替代锂离子,并找到与之匹配的电极和电解液,就可以得到“X离子电池”。在众多“X”的候选者中,铝算是优势比较明显的:它的价格比锂更低,化学性质也更稳定,而且在反应时,每个铝原子可以释放 3 个电子,似乎是个不错的选择。
然而,研发铝离子电池的道路并不顺利。最大的困难在于找到合适的正极材料和电解液。在以往的研究中,正极材料往往会在充放电过程中发生不可逆的结构破坏,能有效参与反应的部分因而越来越少。最终,电池容量迅速下降,使用寿命只有几十个循环——这显然不能满足人们的需求。
在研究者们锲而不舍的努力之下,上月,铝离子电池终于迎来了大突破。斯坦福大学化学系的戴宏杰教授在《自然》发文宣布,他的研究小组成功制造出了超长寿命的铝离子电池。

戴宏杰(右)和文章的共同第一作者之一龚明(左)图片来源: Mark Shwartz/Stanford Precourt Institute for Energy
这种电池选用铝金属作为负极,正极则是一种三维结构的泡沫石墨。秘制电解液由有机盐 [EMIm]Cl(1-ethyl-3-methylimidazolium chloride) 和 AlCl3 按一定比例混合制成的离子液体。负责在电解液中转移电荷的离子是 AlCl4-。电池放电时,铝负极被氧化生成 Al2Cl7-,同时释放电子;本来嵌入在泡沫石墨正极孔隙中的 AlCl4-则脱嵌进入电解液。充电时,电解液中的 AlCl4- 则重新嵌入到泡沫石墨孔隙当中。因为 AlCl4-离子的体积较大,因此找到一种可以允许它快速嵌入/脱嵌的的正极材料颇为关键。研究人员巧妙地制备了泡沫石墨——它内部充满空隙,表面积很大,让 AlCl4-离子可以快速自由地进出。
 以泡沫镍为模板,研究者先用化学气相沉积法在它的表面沉积上石墨,再覆盖上一层聚合物 PMMA;接着用相应溶剂将泡沫镍和 PMMA 相继溶解,得到三维结构的泡沫石墨。用普通非泡沫热解石墨做正极的话,铝离子电池的充放电速率只有使用泡沫石墨时的 75 分之一。图片来源:参考文献[1]
以泡沫镍为模板,研究者先用化学气相沉积法在它的表面沉积上石墨,再覆盖上一层聚合物 PMMA;接着用相应溶剂将泡沫镍和 PMMA 相继溶解,得到三维结构的泡沫石墨。用普通非泡沫热解石墨做正极的话,铝离子电池的充放电速率只有使用泡沫石墨时的 75 分之一。图片来源:参考文献[1]
在经过惊人的 7500 次充放电循环后,这些铝离子电池的容量几乎没有损失,工作电压也稳定在 2 伏左右。除了寿命长,这种铝离子电池功率密度也很高(3000W·kg–1),可以在一分钟内充满电。此外,它们柔性极好,可以随意弯曲;安全性能也超棒,哪怕用电钻将它钻穿,也不会影响它正常工作。

锂离子电池被戳开一个洞很可能带来严重的后果,但用钻头(Drill)钻穿戴宏杰研究组的铝离子电池,电池依然能正常工作。图片来源:stanford.edu
取而代之?
说了这么多优点,这样的铝离子充电电池什么时候能走进我们的生活?
恐怕还早得很。
目前,它的工作电压只有锂离子电池的一半,能量密度也只有 40 Wh·kg–1,与铅酸电池相当,还不到锂离子电池的三分之一,所以大家应该还没法在智能手机、笔记本电脑或电动汽车里看到它。除了性能的提高还潜力很大之外,这些铝离子电池的生产成本也有待降低——它的电解液使用离子液体,价格较高;用于制备泡沫石墨正极的化学气相沉积法也不便宜、是很难投入大规模生产的工艺。要达到“物美价廉”,研究者们还有很长的路要走。
但不管怎样,铝离子电池在使用寿命、功率密度和安全性方面的性能依然优越,如果未来可以降低生产成本,它们将会十分适合用于在对能量密度要求不高的地方发挥作用。比如在电网储能系统中,它们能为太阳能和风能等可再生能源储能。一旦科学家能够研发出比泡沫石墨更好的正极材料,进一步提高铝离子电池的工作电压,它的用途将更加广泛。随身听走了,MP3 也快走了,科技产品一代又一代地从我们的生活中出现又淘汰,电池和研究电池的人却一直还在。之后还会有怎样的电池惊艳我们的生活?给装备充好电,拭目以待吧。
(编辑:Calo)
果壳网已经加入《自然》出版集团媒体分享白名单,点击文中的论文链接即可免费阅读全文。
参考文献:
- Lin, Meng-Chang, et al. An ultrafast rechargeable aluminium-ion battery. Nature (2015).
- Nagaura, T. & Tozawa, K. Lithium ion rechargeable battery. Prog. Batteries Solar Cells 9, 209 (1990).
- Wessells, et al. Investigations of the Electrochemical Stability of Aqueous Electrolytes for Lithium Battery Applications. Electrochemical and Solid-State Letters 13, no. 5 (May 1, 2010): A59–61.
- Chen, Z. et al. Three-dimensional flexible and conductive interconnected graphene networks grown by chemical vapour deposition. Nature Mater. 10, 424–428 (2011)
文章题图:techtree.com










![[HBLOG]公众号](http://www.liuhaihua.cn/img/qrcode_gzh.jpg)

